Studien zu Long Covid
ein Teil der Coronainfizierten entwickelt ME/CFS
Das Forscherinnen-Team „Patient Led Research For COVID-19“ hat einen Preprint zu anhaltenden Symptomen nach einer Coronainfektion veröffentlicht. Von Betroffenen, die mindestens 28 Tage nach der Infektion mit SARS-CoV-2 weiterhin Symptome berichteten, litten auch nach 6 Monaten noch 91,8 % an persistierenden Symptomen. Nach 6 Monaten waren die drei häufigsten Symptome Fatigue, Post-Exertional Malaise und Brain Fog (kognitive Dysfunktion).
Die Autor*innen des Patient Led Research-Teams betonen, dass der bisherige öffentliche Diskurs rundum Covid-19 sich auf schwere Krankheitsverläufe und Sterblichkeit konzentriert, und dabei die Morbidität unterschätzt habe. Sie definieren die Erkrankung Long Covid als eine Ansammlung von Symptomen, die nach einem bestätigten oder Coivd-19 Fall mehr als 28 Tage anhalten. Das Autorenteam ist selbst von Covid-19 betroffen und möchte mit patientengeleiteter Forschung einen Grundstein an Evidenz für zukünftige medizinische Untersuchungen legen, die Versorgungslage verbessern und für die Interessen von Long Covid-Betroffenen eintreten. Die jetzige Studie des Teams knüpft an einen vorherigen Bericht an, der in zahlreichen Medienartikeln und medizinischen Fachzeitschriften zitiert wurde, und welchen das Team der WHO, den CDC und den NIH vorgetragen hatte.
Ausführliche Informationen zur Studie
Die jetzige Studie wurde in Form eines web-basierten Fragebogens durchgeführt, für den N = 3762 Personen aus 56 Ländern über Covid-19-Selbsthilfegruppen und soziale Medien rekrutiert wurden. 78,9 % der teilnehmenden Personen waren weiblich, 27 % hatten eine labor-bestätigte Covid-19-Diagnose und 8,4 % waren hospitalisiert gewesen. In die Studie eingeschlossen wurden Personen mit einem Alter von mindestens 18 Jahren, einem Krankheitsbeginn zwischen Dezember 2019 und Mai 2020 und einer Krankheitsdauer von mindestens 28 Tagen.
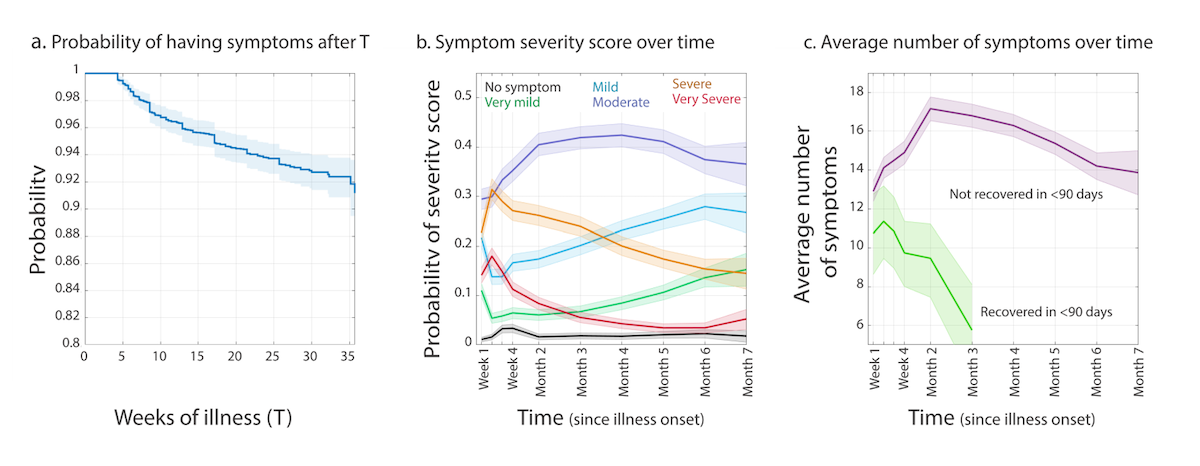
Abb. 1: Entnommen und adaptiert aus Davis et al. (2020), CC BY-NC 4.0.
Die Ergebnisse zu Symptomen und Schwere im Zeitverlauf zeigen, dass ein Großteil der Long-Covid-Betroffenen (91,8 %) auch noch 7 Monate nach Krankheitsbeginn an Symptomen leidet (Abb. 1a). Die Schwere der Symptome scheint tendenziell abzunehmen, aber auch nach 7 Monaten stufte die Mehrheit der Studienteilnehmer*innen ihre Symptome als moderat ein (Abb. 1b). Die Anzahl der berichteten Symptome hatte im Schnitt ihren Höhepunkt in Monat 2 seit Krankheitsbeginn und flachte anschließend in den Folgemonaten leicht ab, auf durchschnittlich 13,8 Symptome in Monat 7 (Abb. 1c).
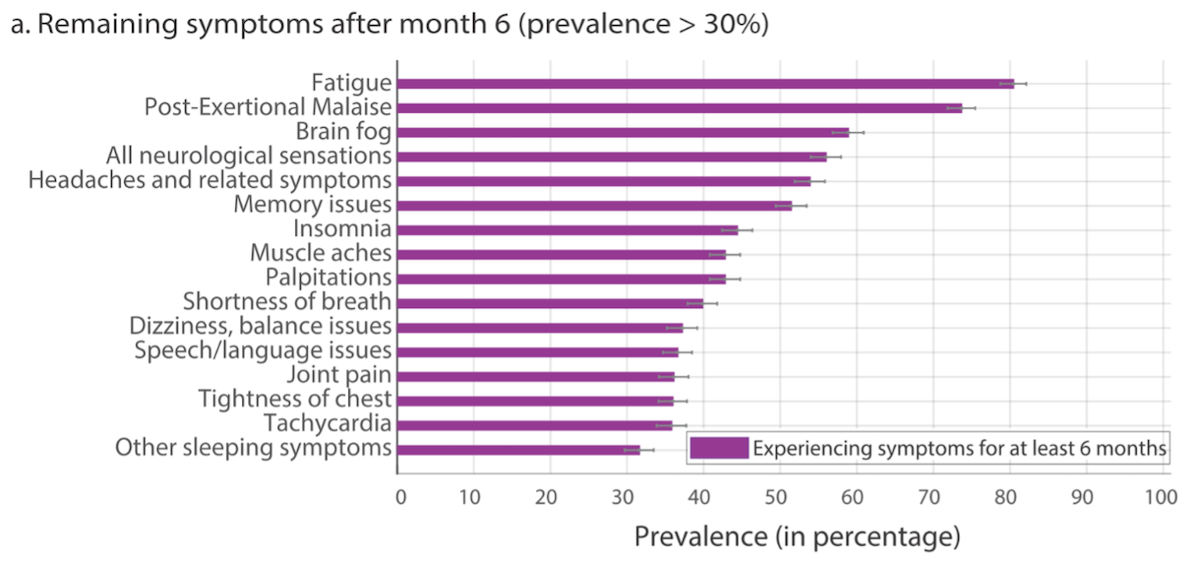
Abb. 2: Entnommen und adaptiert aus Davis et al. (2020), CC BY-NC 4.0.
Die 5 häufigsten Symptome nach 6 Monaten Krankheitsdauer waren Fatigue (80 %), Post-Exertional Malaise (73,3 %), Brain Fog (58,4 %), sensomotorische Symptome (55,7 %) und Kopfschmerzen (53,6 %) (siehe Abbildung 2).
Abb. 3 Entnommen und adaptiert aus Davis et al. (2020), CC BY-NC 4.0.
Nicht genesene Long-Covid-Betroffene gaben an, im Schnitt bei 59,2 % ihrer pre-Covid-Baseline zu sein, während genesene Long-Covid-Betroffene mit 86,5 % signifikant näher an ihrer pre-Covid-Baseline waren (Abb. 3c). Bei 72,7 % der nicht genesenen Betroffenen hatte Long Covid einen negativen Effekt auf ihre Arbeit, 23,3 % konnten sogar gar nicht mehr arbeiten (Abb. 3d).
Methodische Kritik
Wie die Autor*innen im Abschnitt „Limitations“ selbst berichten, führen Studiendesign und die Auswahl der Studienteilnehmer*innen möglicherweise zu verzerrten Ergebnissen. Da die Teilnehmenden ihre Symptome und deren Verlauf über die letzten 7 Monate retrospektiv angaben, könnten hier Erinnerungseffekte („recall bias“) eine Rolle spielen. Außerdem sorgt die Rekrutierung über Selbsthilfegruppen und soziale Medien für eine potenzielle Stichprobenverzerrung („sampling bias“). Die Teilnehmer*innen hatten nach Angaben der Autor*innen einen erhöhten sozioökonomischen Status, waren vor allem Englisch sprechend und im Vergleich zur Gesamtbevölkerung seltener BIPoC (Black, Indigenous and People of Color).
In die Studie wurden auch Personen mit vermuteter Covid-19-Erkrankung, aber ohne laborbestätigte SARS-CoV-2-Infektion (PCR, Antigen oder Antikörper) aufgenommen. Allerdings zeigte sich zu denen mit bestätigter Infektion mit der Ausnahme des Verlustes von Geruchs- und Geschmackssinn kein Unterschied, was Schwere und Verlauf der Symptome angeht. Zwischen den Gruppen PCR-positiv vs. PCR-negativ unterschied sich der Median der Tage nach Symptombeginn bis zum PCR-Test (6 vs. 43 Tage). Die Autor*innen führen als mögliche Erklärung falsch-negative PCR-Ergebnisse an und weisen auf Kucirka et al. (2020) hin, die nach 21 Tagen nach Symptombeginn eine Falsch-Negativ-Rate von 66 % ermittelten. Daraus schlussfolgernd betonen die Autor*innen, dass negative SARS-CoV-2-Diagnostik oder Antikörpertests kein Indikator sein sollten, um Long Covid bei Patient*innen auszuschließen, wenn deren Symptome darauf hindeuten. Alwan und Johnson (2020) schlagen in einem Preprint vor, wie eine zurückliegende Covid-19 Erkrankung ohne labordiagnostische Tests retrospektiv diagnostiziert werden könnte.
Überschneidung mit ME/CFS
Der bisher umfangreichste Bericht zu ME/CFS, „Beyond ME/CFS: Redefining an illness“ des ehemaligen Institute of Medicine (heute National Academy of Medicine), beschreibt das Symptom Post-Exertional Malaise (PEM) als für die Krankheit charakteristisches und differentialdiagnostisch relevantes Symptom. PEM zeichnet sich durch eine ausgeprägte und anhaltende Verstärkung aller Symptome nach geringer körperlicher und/oder geistiger Anstrengung aus. Diese kann sowohl unmittelbar als auch 12 bis 48 Stunden nach der Belastung auftreten. Von PEM, das Patient*innen häufig in Form von „Crashs“ beschreiben, leitet sich das als „Pacing“ bezeichnete Aktivitätsmanagement ab, das wir in einem vorherigen Beitrag näher beschrieben haben. Dieses dient dazu, Symptomverschlechterungen („Crashs“, „Flare-Ups“) zu vermeiden und somit eine Krankheitsstabilisierung zu ermöglichen.
Dass in der Long-Covid-Studie 89,1 % der Studienteilnehmer*innen angaben, im Krankheitsverlauf PEM erlebt zu haben, und auch nach 6 Monaten Krankheitsdauer noch 73,3 % PEM erleben, deutet darauf hin, dass ein bedeutsamer Teil der Longhauler die ME/CFS-Kriterien erfüllen könnte.
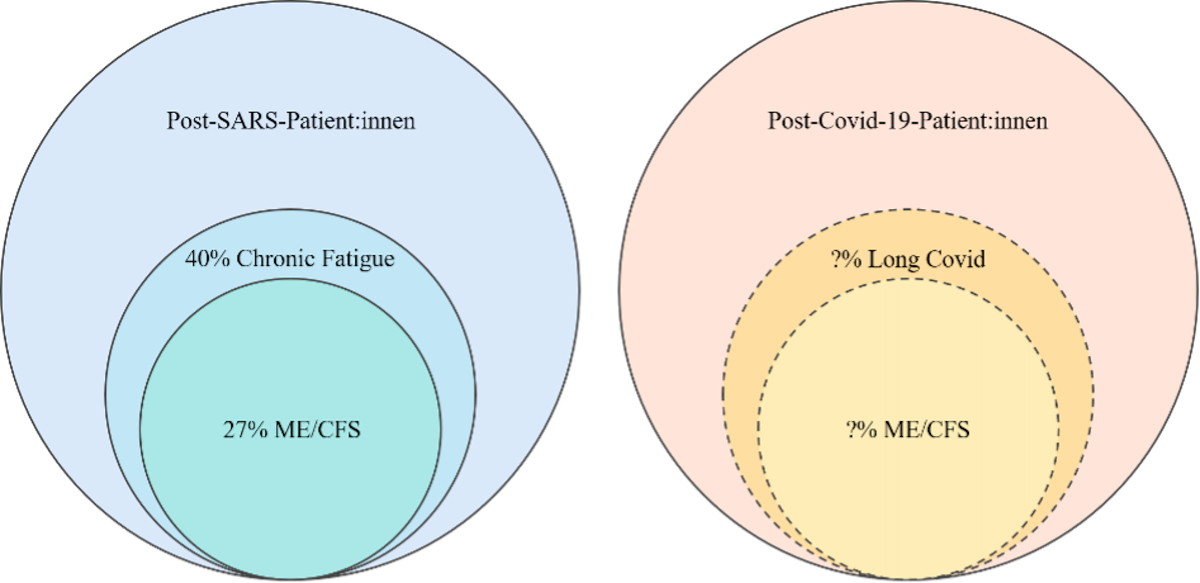
Abb. 4 a. – blau. post-infektiöse Krankheit nach SARS
Abb. 4 b. – rosa. post-infektiöse Krankheit nach Covid-19
Das dem SARS-CoV-2-Virus ähnliche SARS-CoV-1-Virus hatte in der SARS-Pandemie 2003 viele Infizierte mit anhaltenden Symptomen zurückgelassen. Unter ehemals hospitalisierten Patient*innen litten 3,5 Jahre nach SARS in einer Langzeit Follow-Up Studie in Hong Kong von Lam et al. (2009) 40,3 % an chronischer Fatigue und 27,1 % erfüllten die Fukuda-Kritierien für ME/CFS (siehe Abb. 4a).
Zur Häufigkeit von Long Covid gibt es bisher unterschiedliche Zahlen, die je nach Beobachtungszeitraum und Methodologie der Studien zwischen ca. 10 und 50 % der Infizierten variieren. Während experimentelle Daten des britischen Office for National Statistics auf 9,8 % der Infizierten nach 12 Wochen kommen, gaben in der Zürcher Kohortenstudie 26 % der Infizierten nach 6 Monaten an, nicht zu ihrem gewohnten Gesundheitszustand zurückgekehrt zu sein. In einer prospektiven Studie an der University of Washington berichteten ca. 30 % nach 6 Monaten von persistierenden Symptomen und in einer ebenfalls prospektiven Studie auf den Färöer-Inseln waren es sogar 53,1 %, die nach durchschnittlich 125 Tagen mindestens ein anhaltendes Symptom hatten.
Wie viele der Longhauler könnten an ME/CFS leiden? Komaroff & Bateman (2020) vermuten, dass eine Mehrheit der Longhauler die SEID-Kriterien für ME/CFS erfüllen könnte. In ihrem Meinungsartikel „Will COVID-19 Lead to ME/CFS?“, erschienen in der Fachzeitschrift Frontiers in Medicine, stellen Komaroff und Bateman die in ihren Augen konservative Schätzung auf, dass 10 % der Covid-Patient*innen an ME/CFS erkranken könnten. Dabei stützen sie sich auf eine prospektive Studie von Hickie et al. (2006), in der sowohl virale Pathogene (Epstein-Barr-Virus, Ross-River-Virus) als auch nicht-virale Pathogene (Coxiella burnetii) ME/CFS auslösten. Ca. 1 von 10 Personen erfüllte in dieser Studie 12 Monate nach der akuten Infektionskrankheit die Fukuda-Kriterien für ME/CFS.
In einer aktuellen Studie (Preprint wurde inzwischen in Nature Communications publiziert, siehe Link) von Claudia Kedor und Kolleg*innen am Charité Fatigue Centrum der Universitätsmedizin Berlin, wurde der Frage nach post-Covid auftretendem ME/CFS nachgegangen. Dabei wurde die Long-Covid-Patientengruppe Langzeit-COVID mit einbezogen. In der prospektiv angelegten Beobachtungsstudie wurden 42 Patient*innen mit bestätigter SARS-CoV-2-Infektion 6 Monate nach ihrer akuten Erkrankung zwischen Juli und November 2020 näher untersucht. Es wurden Patient*innen eingeschlossen, die anhaltende Fatigue, Belastungsintoleranz, neurokognitive Einschränkungen sowie Schmerzen berichteten. Ausgeschlossen wurden Personen mit Organschäden, relevanten Komorbiditäten, ausstehenden kardiopulmonologischen/neurologischen Untersuchungen, oder falls Fatigue bereits vor der Covid-19-Erkrankung berichtet wurde. Zur Diagnose von ME/CFS wurden die Kanadischen Konsenskriteren verwendet.
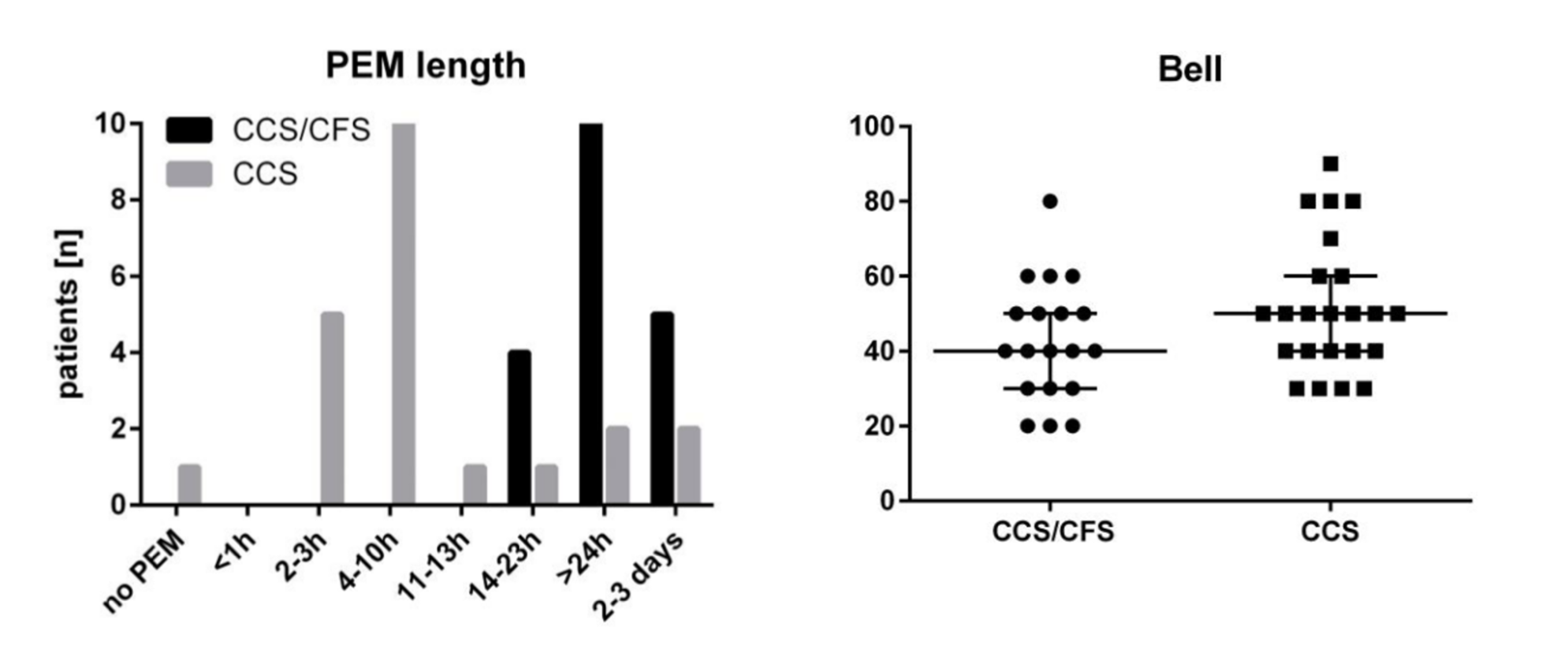
Abb. 5 Entnommen und adaptiert aus Kedor et al. (2021), CC BY-NC 4.0.
Von den 42 untersuchten Patien*tinnen erfüllte knapp die Hälfte (N = 19) die ME/CFS-Kriterien. Für die restlichen 23 verwenden die Autor*innen den Begriff Chronic Covid-19 Syndrome (CCS). Die meisten CCS-Patient*innen (18 von 23) erfüllten die ME/CFS-Kriterien nicht, weil ihre Post-Exertional Malaise weniger als 14 Stunden anhielt (siehe Abb. 5). Den Autor*innen zufolge ist unklar, ob die Unterscheidung in Subgruppen auf Basis der Dauer von PEM bedeute, dass ein unterschiedlicher Krankheitsmechanismus vorliegt oder dass es sich lediglich um eine unterschiedlich schwere Symptomausprägung auf einem gemeinsamen Krankheitsspektrum handelt. Einige Symptome wie Fatigue und verringerte Griffkraft waren im Schnitt in der ME/CFS-Gruppe schwerer ausgeprägt. Für beide Gruppen zeigte sich eine starke alltägliche Einschränkung mit einem Medianwert auf der Bell-Skala von 40 (ME/CFS) und 50 (CCS). In beiden Patientengruppen konnten mehr als zwei Drittel gar nicht mehr oder nur in Teilzeit arbeiten (Bell-Score < 60). Die Autor*innen merken allerdings an, dass die Einschlusskriterien der Studie dazu geführt haben könnten, dass eher Personen mit schwereren Symptomen ausgewählt wurden. Zudem wurde in der Rekrutierung nach ME/CFS-ähnlichen Symptomen gescreent. In der gesamten Long-Covid-Population könnte der ME/CFS-Anteil, zumindest nach den Kanadischen Konsenskriterien, geringer sein, als in dieser Studie. Ebenso notieren die Autor*innen, dass weniger strenge Diagnosekriterien, wie die Fukuda- oder die SEID-Kriterien, mehr Long-Covid-Betroffene zu ME/CFS zugehörig klassifiziert hätten.
Long Covid und ME/CFS auch bei Kindern
Für Long Covid bei Kindern und Jugendlichen gibt es bisher die experimentellen ONS-Daten, die in der Altersgruppe von 2–11 Jahren 5 Wochen nach der bestätigten SARS-CoV-2-Infektion bei 12,9 % anhaltente Symptome belegen. Für die Altersgruppe von 12–16 Jahren sind es 14,5 %. Bei einer Umfrage (Preprint) unter N = 510 von Long Covid betroffenen Kindern, berichteten diese im Schnitt 8,2 Monate nach der Infektion eine Vielzahl von Symptomen, darunter gut die Hälfte (53, 7 %) Post-Exertional Malaise. Die Dynamik von Long Covid wurde ebenfalls erfasst: Ein Viertel der Kinder hatte konstant Symptome, die Hälfte hatte Phasen von scheinbarer Erholung gefolgt von einer Rückkehr der Symptome und 19 % berichteten längere Phasen von Wohlbefinden, auf die eine Rückkehr der Symptome folgte.
Dass viele Kinder von PEM berichteten, lässt vermuten, dass auch Kinder post-Covid ME/CFS entwickeln könnten. Unabhängig von Covid-19 zeigte sich pädiatrisches ME/CFS in einer Studie von Leonard Jason et al. (2020) deutlich häufiger als bisher angenommen. Die Prävalenz lag bei Kindern und Jugendlichen in der Altersgruppe von 5–17 Jahren in der Studie bei 0,75 %. Bei weniger als 5 % der betroffenen Kinder war vorher eine ME/CFS-Diagnose gestellt worden.
Redaktion: mth
Quellen
Alwan, N., & Johnson, L. (2020, December 21). Long COVID: where do we start with the case definitions?. https://doi.org/10.31219/osf.io/hndtm
Buonsenso, D.; Espuny Pujol, F.; Munblit, D.; Mcfarland, S.; Simpson, F. Clinical Characteristics, Activity Levels and Mental Health Problems in Children with Long COVID: A Survey of 510 Children. Preprints 2021, 2021030271. https://www.preprints.org/manuscript/202103.0271/v1
Carruthers, B. M., Jain, A. K., De Meirleir, K. L., Peterson, D. L., Klimas, N. G., Lerner, A. M., ... & Van de Sande, M. I. (2003). Myalgic encephalomyelitis/chronic fatigue syndrome: clinical working case definition, diagnostic and treatment protocols. Journal of chronic fatigue syndrome, 11(1), 7-115. https://doi.org/10.1300/J092v11n01_02
Clayton, E. W. (2015). Beyond myalgic encephalomyelitis/chronic fatigue syndrome: an IOM report on redefining an illness. Jama, 313(11), 1101-1102. https://doi.org/10.1001/jama.2015.1346
Davis, H. E., Assaf, G. S., McCorkell, L., Wei, H., Low, R. J., Re’em, Y., ... & Akrami, A. (2020). Characterizing Long COVID in an International Cohort: 7 Months of Symptoms and Their Impact. medRxiv. https://doi.org/10.1101/2020.12.24.20248802
Fukuda, K., Straus, S. E., Hickie, I., Sharpe, M. C., Dobbins, J. G., & Komaroff, A. (1994). The chronic fatigue syndrome: a comprehensive approach to its definition and study. Annals of internal medicine, 121(12), 953-959. https://doi.org/10.7326/0003-4819-121-12-199412150-00009
Hickie, I., Davenport, T., Wakefield, D., Vollmer-Conna, U., Cameron, B., Vernon, S. D., ... & Lloyd, A. (2006). Post-infective and chronic fatigue syndromes precipitated by viral and non-viral pathogens: prospective cohort study. Bmj, 333(7568), 575. https://doi.org/10.1136/bmj.38933.585764.AE
Jason, L. A., Katz, B. Z., Sunnquist, M., Torres, C., Cotler, J., & Bhatia, S. (2020, August). The prevalence of pediatric myalgic encephalomyelitis/chronic fatigue syndrome in a community-based sample. In Child & Youth Care Forum (Vol. 49, No. 4, pp. 563-579). Springer US. https://doi.org/10.1007/s10566-019-09543-3
Kedor, C., Freitag, H., Meyer-Arndt, L. A., Wittke, K., Steinbeis, F., Haffke, M., ... & Scheibenbogen, C. (2021). Chronic COVID-19 Syndrome and Chronic Fatigue Syndrome (ME/CFS) following the first pandemic wave in Germany: a first analysis of a prospective observational study. medRxiv. https://doi.org/10.1101/2021.02.06.21249256
Kedor, C., Freitag, H., Meyer-Arndt, L. et al. (2022). A prospective observational study of post-COVID-19 chronic fatigue syndrome following the first pandemic wave in Germany and biomarkers associated with symptom severity. Nat Commun 13, 5104. https://doi.org/10.1038/s41467-022-32507-6
Komaroff, A. L., & Bateman, L. (2020). Will COVID-19 Lead to ME/CFS?. Frontiers in Medicine, 7, 1132. https://www.frontiersin.org/articles/10.3389/fmed.2020.606824/full
Kucirka, L. M., Lauer, S. A., Laeyendecker, O., Boon, D., & Lessler, J. (2020). Variation in false-negative rate of reverse transcriptase polymerase chain reaction–based SARS-CoV-2 tests by time since exposure. Annals of Internal Medicine. https://doi.org/10.7326/M20-1495
Lam, M. H. B., Wing, Y. K., Yu, M. W. M., Leung, C. M., Ma, R. C., Kong, A. P., ... & Lam, S. P. (2009). Mental morbidities and chronic fatigue in severe acute respiratory syndrome survivors: long-term follow-up. Archives of internal medicine, 169(22), 2142-2147. https://doi.org/10.1001/archinternmed.2009.384
Logue, J. K., Franko, N. M., McCulloch, D. J., McDonald, D., Magedson, A., Wolf, C. R., & Chu, H. Y. (2021). Sequelae in adults at 6 months after COVID-19 infection. JAMA Network Open, 4(2), e210830-e210830. https://jamanetwork.com/journals/jamanetworkopen/fullarticle/2776560
Petersen, M. S., Kristiansen, M. F., Hanusson, K. D., Danielsen, M. E., Gaini, S., Strøm, M., & Weihe, P. (2020). Long COVID in the Faroe Islands-a longitudinal study among non-hospitalized patients. Clinical Infectious Diseases. https://doi.org/10.1093/cid/ciaa1792