Fatigue ist ein medizinischer Fachbegriff, mit dem eine krankhafte Schwäche bezeichnet wird. Fatigue tritt häufig bei chronischen Erkrankungen auf.
Fatigue
Fatigue
häufiges Symptom bei chronischen Erkrankungen
Fatigue ist ein medizinischer Fachbegriff, mit dem eine krankhafte Schwäche bezeichnet wird. Fatigue tritt häufig bei chronischen Erkrankungen auf, so z. B. bei Multipler Sklerose, rheumatoider Arthritis, Krebserkrankungen oder bei der Myalgischen Enzephalomyelitis/dem Chronischen Fatigue Syndrom (ME/CFS).
Bei ME/CFS ist die Fatigue chronisch und lässt sich durch Schlaf, Erholung oder Sport nicht bessern. Im Gegensatz zu anderen Erkrankungen kann bei ME/CFS jede Form von Anstrengung, auch Sport, die Fatigue aufgrund der Post-Exertionellen Malaise verschlechtern. Zum Management der Fatigue sowie der gesamten ME/CFS-Symptomatik wird die Pacing-Strategie angewandt.
In der aktuellen britischen ME/CFS-Leitlinie werden verschiedene Komponenten aufgeführt, die Fatigue ausmachen:
- grippeähnliches Gefühl, vor allem zu Beginn der Krankheit
- Unruhe oder das Gefühl, aufgedreht aber trotzdem erschöpft zu sein („wired but tired“)
- geringe Energie oder mangelnde körperliche Kraft, um Aktivitäten des täglichen Lebens zu beginnen oder zu beenden sowie körperlich ausgelaugt sein
- kognitive Fatigue, die bestehende Schwierigkeiten verschlimmert
- rascher Verlust von Muskelkraft oder Ausdauer nach dem Beginn einer Tätigkeit, was z. B. zu plötzlicher Schwäche, Ungeschicklichkeit, mangelnder Koordination und der Unfähigkeit, körperliche Anstrengungen konstant zu wiederholen, führt.
Die Schwere der Einschränkung und Behinderung, die das Symptom mit sich bringt, kann der Begriff „Fatigue“ allerdings häufig nicht vermitteln. Whitney Dafoe, der an sehr schwerem ME/CFS leidet, beschreibt Fatigue beispielsweise als „Total body shut down“ (Dafoe, 2021). Der umfassende ME/CFS-Report des US-amerikanischen Institute of Medicine liefert weitere Beschreibungen schwerer Fatigue bei ME/CFS, so z. B. „zu erschöpft, um mehr als alle 7–10 Tage die Kleidung zu wechseln“, „Erschöpfung bis zu dem Punkt, an dem das Sprechen nicht mehr möglich ist“ und „Die Anstrengung des täglichen Toilettengangs, insbesondere des Stuhlgangs, führt dazu, dass ich nach Atem ringend ins Bett zurückkehre und mich fühle, als hätte ich gerade einen Berg bestiegen“.
Während Fatigue ein häufiges Symptom chronischer Erkrankungen darstellt und nicht spezifisch für ME/CFS ist, ist die Post-Exertionelle Malaise das charakteristische Leitsymptom, das ME/CFS gut von anderen chronischen Erkrankungen mit Fatigue unterscheidet (Cotler et al., 2018). Post-Exertionelle Malaise bezeichnet eine Verschlechterung der gesamten ME/CFS-Symptomatik nach geringfügiger körperlicher und/oder geistiger Anstrengung. Diese belastungsinduzierte Zustandsverschlechterung kann unmittelbar oder mit einer Zeitverzögerung von 12 bis 48 Stunden nach der durchgeführten Aktivität auftreten.
Die für ME/CFS verwendete Bezeichnung Chronisches Fatigue Syndrom wurde von einer Arbeitsgruppe der US-amerikanischen CDC (Centers for Disease Control and Prevention) Ende der 1980er-Jahre vorgeschlagen (Holmes-Kriterien von 1988). Prof. Anthony Komaroff, der Teil dieser Arbeitsgruppe war, bezeichnet in einem Interview aus dem Jahr 2016 die Namensgebung als großen Fehler, da die Bezeichnung Chronic Fatigue Syndrome die Erkrankung trivialisiere und stigmatisiere. Es ließe die Krankheit als unwichtig oder sogar nicht real erscheinen.
Tatsächlich ergeben Befragungen, dass ein Drittel bis die Hälfte der Ärzt*innen ME/CFS als klinische Entität nicht anerkennt (Pheby et al., 2021). ME/CFS-Betroffene berichten immer wieder von starker Stigmatisierung durch medizinisches Personal und durch das soziale Umfeld (Froehlich et al., 2021; EFNA-Umfrage).
Zur treffenderen Bezeichnung von ME/CFS schlug das US-amerikanische Institute of Medicine (umbenannt in National Academy of Medicine) 2015 den Begriff Systemic Exertion Intolerance Disease (deutsch: Systemische Belastungsintoleranz-Erkrankung) vor. Dieser zielt auf die für ME/CFS charakteristische Post-Exertionelle Malaise ab. Die Krankheitsbezeichnung hat sich jedoch nicht durchgesetzt.
Fokus auf Fatigue statt PEM bringt fragwürdige Forschungsergebnisse und kontraindizierte Therapieansätze
Neben der Namensgebung lag auch der Fokus früherer Diagnosekriterien für ME/CFS fälschlicherweise auf Fatigue statt auf dem Leitsymptom Post-Exertionelle Malaise (PEM). Während alle aktuellen Kriterien für eine ME/CFS-Diagnose das Vorliegen von PEM verpflichtend vorsehen (Kanadische Konsenskriterien 2003, Internationale Konsenskriterien 2011, IOM-Kriterien 2015, NICE-Kriterien 2021), klassifizierten frühere Kriterien Patient*innen mit chronischer Fatigue auch ohne PEM zu ME/CFS. Dadurch verschwamm das Krankheitsbild mit anderen Erkrankungen mit Fatigue. In der klinischen Praxis sowie bei der Rekrutierung von Studienteilnehmer*innen entstand eine heterogene Patientengruppe, die auf therapeutische Interventionen unterschiedlich reagierte.
Als Therapien für ME/CFS wurden lange aufgrund des Symptoms Fatigue körperliches Aufbautraining und aktivierende kognitive Verhaltenstherapie empfohlen. Es gibt jedoch keine wissenschaftliche Evidenz, dass dies wirksame Behandlungen für ME/CFS sind. So wurden beispielsweise im Rahmen der Ausarbeitung der britischen ME/CFS-Leitlinie bei einer umfassenden systematischen Literaturrecherche (dem Goldstandard) die Studien zu aktivierenden Therapien vom Leitlinienkomitee sowie von NICE-Fachpersonal eingehend geprüft. Von 236 Ergebnissen aus Studien zu körperlichem Aufbautraining und aktivierender kognitiver Verhaltenstherapie für ME/CFS, wurde die Qualität der Evidenz für 205 Ergebnisse mit „sehr niedrig“ und der restlichen 31 mit „niedrig“ bewertet.
Kein Resultat schaffte es auch nur als mittelmäßig bewertet zu werden. Zudem bestätigen groß angelegte Umfragen unter Menschen mit ME/CFS, dass beide Behandlungen nicht wirken, dagegen aber aufgrund von PEM potenziell schaden und die Symptomatik dauerhaft verschlechtern können (Geraghty et al., 2017). Inzwischen lehnen alle großen Gesundheitsbehörden weltweit – wie die amerikanischen Centers for Disease Control and Prevention (CDC), das britische NICE und die Weltgesundheitsorganisation (WHO) – aufgrund der Evidenzlage aktivierende Therapien für ME/CFS ab. Der Fokus liegt bei der Diagnose, Behandlung und Erforschung von ME/CFS auf dem Leitsymptom PEM. Statt Aktivierung wird Pacing zum Energie- und Aktivitätsmanagement empfohlen (siehe ausführliche Informationen zur Pacing-Strategie).
Der frühere Fokus auf Fatigue kostete ME/CFS-Betroffene allerdings Jahrzehnte, in denen die Erkrankung missverstanden wurde. Insbesondere aufgrund der Fehlannahme, bestehende aktivierende nicht-pharmakologische Interventionen seien angemessen und ausreichend, gab es kaum wissenschaftliches Interesse, biomedizinische Forschung und Förderung. Die Folge ist, dass es über 50 Jahre nach Klassifizierung als neurologische Erkrankung durch die WHO keine zugelassene Therapie und keine flächendeckenden Versorgungs- und Forschungsstrukturen für ME/CFS gibt.
Pathomechanistische Erklärungsansätze: gestörter Energiestoffwechsel aufgrund von Hypoxie?
Der Mechanismus hinter der Entstehung von Fatigue ist bei ME/CFS, wie auch bei anderen chronischen Erkrankungen, noch ungeklärt. Es existieren allerdings einige Erklärungsansätze, bei denen eine Dysfunktion des Energiestoffwechsels eine zentrale Rolle spielt.
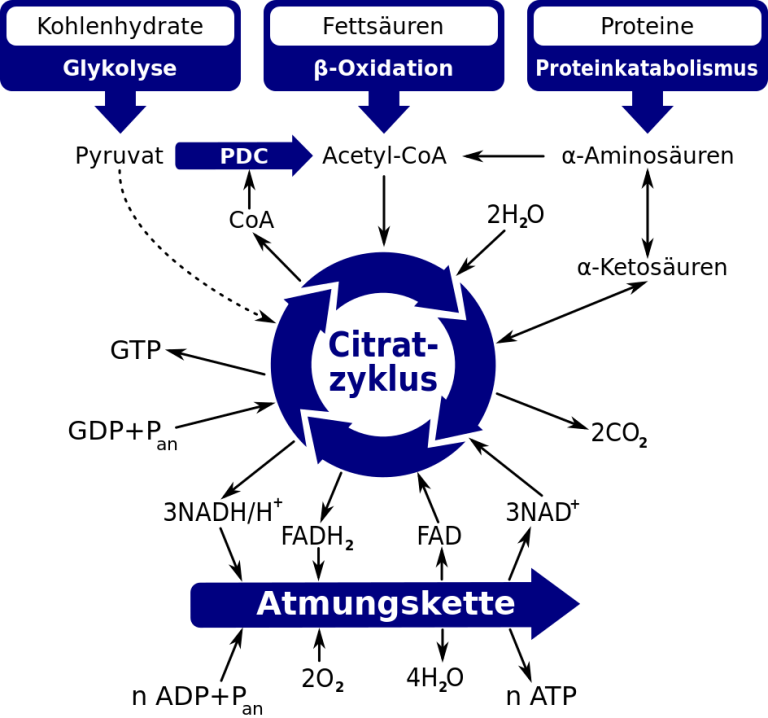
Zahlreiche Parameter, die für den Energiestoffwechsel und die Funktionalität der Mitochondrien im menschlichen Körper relevant sind, zeigen sich bei ME/CFS-Betroffenen signifikant verändert. So weisen mehrere Studien mit unterschiedlichen Messmethoden auf eine eingeschränkte Produktion von Adenosintriphosphat (ATP) hin (Brown et al., 2018; Tomas et al., 2017; Missailidis et al., 2020; Tomas et al., 2020; Sweetman et al., 2020; Che et al., 2022). ATP ist ein ganz zentraler Energieträger im menschlichen Körper und wird in den Mitochondrien („die Kraftwerke der Zelle“) hergestellt. ME/CFS-Patient*innen haben zudem ein verändertes Aminosäureprofil und eine veränderte mRNA-Expression, die auf eine funktionelle Einschränkung des Enzyms Pyruvat-Dehydrogenase (PDH) hindeuten (Fluge et al., 2016; hier zusammengefasst von der Deutschen Gesellschaft für ME/CFS). Damit Mitochondrien ATP herstellen können, muss die PDH das in der Glykolyse hergestellte Pyruvat in Acetyl-CoA umwandeln. Acetyl-CoA benötigt der Körper für den Citratzyklus, der wiederum Stoffe liefert, die für die Herstellung von ATP über die Atmungskette notwendig sind. Eine eingeschränkte Funktion der PDH hätte eine Störung des gesamten Energiestoffwechsels zur Folge.
Für eine funktionierende ATP-Synthese über die Atmungskette wird außerdem Sauerstoff (O2) benötigt. Allerdings ist bei ME/CFS die (Mikro)-Zirkulation des Blutes und damit auch die Sauerstoffversorgung des Gewebes eingeschränkt (Campen et al., 2020; Joseph et al., 2021). Bei fehlendem Sauerstoff zur aeroben Energiegewinnung schaltet der Körper auf anaerobe Energiegewinnung um, bei der Laktat entsteht. Tatsächlich zeigt sich bei ME/CFS bei wiederholten Belastungstests eine abnormale Akkumulation von Laktat (Lien et al., 2019). In der Cerebrospinalflüssigkeit finden sich bei ME/CFS auch im Ruhezustand erhöhte Laktatwerte (Shungu et al., 2012), bei einem Teil der ME/CFS-Patient*innen auch im Blut (Ghali et al., 2019). Hierfür könnte der Grund ein Mangel an verfügbarem Sauerstoff (Hypoxie) sein.
Für die bei ME/CFS beobachtete eingeschränkte Sauerstoffversorgung spielen zwei Befunde eine wichtige Rolle: 1) Die in mehreren Studien replizierte endotheliale Dysfunktion: eine gestörte Gefäßweitenregulation der Blutgefäße, die mit einer eingeschränkten Blutzirkulation einhergeht (z. B. Haffke et al., 2022). 2) Die verminderte Verformbarkeit roter Blutkörperchen, die für ME/CFS gezeigt wurde (Saha et al., 2019), und auch bei Long COVID repliziert werden konnte (Kubánková et al., 2021). Die roten Blutkörperchen binden Sauerstoff und transportieren ihn über die Blutgefäße zu den Sauerstoff benötigenden Organen. Bei einer reduzierten Verformbarkeit kommen die Blutkörperchen weniger gut durch die kleinsten Blutgefäße (Kapillaren), sodass die Mikrozirkulation des Blutes und somit auch die Sauerstoffversorgung eingeschränkt ist.
Warum es bei ME/CFS zu einer endothelialen Dysfunktion und einer verminderten Verformbarkeit roter Blutkörperchen kommt, ist noch nicht abschließend geklärt. Als mögliche Ursache kommen Autoantikörper gegen G-Protein-gekoppelte Rezeptoren (GPCR), insbesondere den ß-2-Adrenorezeptor (Wirth & Scheibenbogen, 2020), sowie gegen Endothelzellen (Flaskamp et al., 2022) in Frage. Das Level der GPCR-Autoantikörper korreliert bei ME/CFS mit der Symptomschwere, auch mit der Schwere der Fatigue (Freitag et al., 2021; Sotzny et al., 2022). Der ß-2-Adrenorezeptor ist insbesondere für die Gefäßerweiterung (Vasodilatation) zuständig und eine dauerhafte Aktivierung des Rezeptors durch GPCR-Autoantikörper könnte zu einer Desensitivierung des Rezeptors führen, sodass dieser auf seine Liganden (z. B. Adrenalin) nicht mehr adäquat reagiert und es zu einer Störung der Gefäßweitenregulation (endotheliale Dysfunktion) kommt. Der ß-2-Adrenorezeptor kommt außerdem auch auf Erythrozyten (rote Blutkörperchen) vor. Semenov et al. (2019) konnten beispielsweise zeigen, dass die Stimulation des Rezeptors mittels ß-2-Agonisten die Verformbarkeit roter Blutkörperchen bei gesunden Menschen beeinflusst.
Der Citratzyklus im Überblick: Das bei ME/CFS eingeschränkte Enzym Pyruvat-Dehydrogenase (im Schaubild mit PDC abgekürzt) synthetisiert aus Pyruvat das für den Energiestoffwechsel wichtige Acetyl-CoA. In der Atmungskette wird u. a. mithilfe von Sauerstoff, dessen Verfügbarkeit bei ME/CFS reduziert ist, aus ADP der wichtige Energieträger ATP hergestellt. Entnommen aus Wikimedia (gemeinfreie Lizenz).
Laktatbildung: Bei der ohne Sauerstoff auskommenden anaeroben Energieproduktion entsteht Laktat, welches sich bei ME/CFS in einigen Untersuchungen als erhöht erwiesen hat. Entnommen aus Wikimedia (gemeinfreie Lizenz).
Das Symptom Fatigue wird bei ME/CFS mithilfe von Fragebögen standardisiert erhoben. In Klinik und Forschung wird beispielsweise die Chalder Fatigue Scale verwendet, die allerdings wegen möglicher Deckeneffekte und unpräziser Formulierung kritisiert wird (siehe MEpedia-Artikel). Jason et al. (2011) haben verschiedene Fatigue-Fragebögen hinsichtlich der Sensitivität und Spezifität zur Unterscheidung von ME/CFS-Betroffenen und gesunden Kontrollen verglichen. Dabei schnitt die Fatigue Severity Scale am besten ab.